-
Produkter
- Laboratorieinstrumenter
-
Målere og elektroder til laboratoriebrug
Sension+ metre og prober Kalibreringsstandarder
- Kemikalier, reagenser og standarder
-
Online Analysers
Fosfatanalysatorer
- NP6000sc
- FX610/FX620 system
- Filtrax System
- 5500 sc
- 9611 sc
- NP6000sc Chemistry/Reagents
- Phosphax Sigma
- Phosphax sc
- Phosphax sc LR
EZ Series Analysers- Iron
- Aluminium
- Manganese
- Phosphate
- Chloride
- Cyanide
- Fluoride
- Sulphate
- Sulphide
- Arsenic
- Chromium
- Copper
- Nickel
- Zinc
- Ammonium
- Total Nitrogen
- Total Phosphorus
- Phenol
- Volatile Fatty Acids
- Alkalinity
- ATP
- Hardness
- Toxicity
- Sample Preconditioning
- Boron
- Colour
- Nitrate
- Nitrite
- Silica
- Hydrogen Peroxide
- EZ Series Reagents
- EZ Series Accessories
- EZ sc Series Inorganics
- EZ sc Series Metals
- EZ sc Series Nutrients
-
Onlinesensorer og -kontrolenheder
Digitale kontrolenheder (transmittere) Kontrolenheder (analog)
- SC4500
- Orbisphere 366x Ex
- Orbisphere 410/510 Carbon Dioxide
- Orbisphere 410/510 Oxygen
- Orbisphere 410/510 Ozone
pH og ORP sensorer- 1200-S Redox
- 1200-S pH
- 12mm pH/Redox
- 8362 sc High Purity
- Digitale Differentiale Redox
- Digitale Differentiale pH
- Automatiserede laboratoriesystemer
- Claros Water Intelligence System
- Prøveudtagning
-
Laboratorieudstyr og forsyninger
Apparater
- Børster
- Clamps, Rings & Stands
- Crucibles
- Crucibles & Casseroles
- Dispensers & Droppers
- Grab Samplers
- Oil and Grease
- Pipet Aids
- Pipetter
- Slanger
- Stir Bars
- Strativer
- Weighing Accessories
- Øvrige apparater
Generelle laboratorieforbrugsvarer Glas-/plastvarerInstrumenter -
Mikrobiologi
Dehydrerede medier Forberedte medierInstrumenter Labware
- Testsæt og -strips
- Electrochemistry
- PARAMETRE
-
Softwareløsninger
-
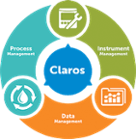
Claros Water Intelligence System
Product Pillars Process Management
- Løsninger til:
- BOD/COD fjernelse
- Nitrifikation/denitrifikation
- Fosforudledning
- Slamstyring
Data Management- Løsninger til:
- Dataopsamling
- Visualisering og analyse
- Rapportering
- Datanøjagtighed
Instrument Management- SLøsninger til:
- Vedligeholdelse
- Fejlfinding
- Fjernadgang
- Laboratorie- og processammenligning
-
Claros Water Intelligence System
- Industrier
- Service
- Nyheder og Events
Danmark
Vælg land eller region:
Europe
Americas
Asia - Australasia
- Australia
- Mainland China
- India
- Indonesia
- Japan
- Malaysia
- New Zealand
- Philippines
- Singapore
- South Korea
- Thailand (Thai)
- Taiwan
- Vietnam
Middle East - Africa
Ammoniak og ammonium
Hvad er ammoniak?
Ammoniak er en farveløs, skarp gasblanding af hydrogen og nitrogen (et nitrogenatom og tre hydrogenatomer, NH 3), som er meget opløselig i vand.
Ammoniak dannes naturligt som et produkt af mikrobiologisk nedbrydning af kvælstofholdige organiske stoffer (animalsk og planteprotein). Den kan også fremstilles til brug i gødning eller til brug ved fremstilling af plast, lægemidler og andre kemikalier.
Ammoniak i grundvandet er normalt på grund af mikrobiologiske processer. Men tilstedeværelsen af ammoniaknitrogen i overfladevand er normalt et tegn på forurening. Overskydende ammoniak kan beskadige vegetationen og er utrolig giftig for vandorganismer, især ved høje pH- og temperaturniveauer.
Ammoniak i vand
Til forskellige opgaver opløses ammoniak i vand for at producere "vandigt ammoniak". Massefremkomster af vandige ammoniakopløsninger er ustabile, og ammoniakkoncentrationen kan falde under transport eller ved opbevaring. Derfor afregnes leverede opløsninger på basis af den ammoniakkoncentration, der leveres til anlægget eller slutbrugeren.
Hvad er ammonium?
Ammonium er en forbindelse, der indeholder et nitrogenatom og fire hydrogenatomer (NH 4 +). Ammoniak er et neutralt ikke-ioniseret molekyle (svag base), men ammonium er en ion med positiv ladning. Desuden afgiver ammoniak en stærk lugt, mens ammonium slet ikke lugter.
Den vigtigste faktor, der bestemmer ammoniakandelen til ammonium i vand, er pH. Ammoniakkens aktivitet påvirkes også af opløsningens ionstyrke og temperatur. Det er vigtigt at huske på, at selvom molekylær ammoniak kan være skadelig for organismer, der lever i vand, er ammoniumion grundlæggende uskadelig. I vandindustrien er det vigtigt at kende koncentrationerne af hydrogenbundet kvælstof. Termerne ammoniak og ammonium anvendes derfor i flæng og skrives tilsvarende som NH 3 -N eller NH 4 -N og er normalt udtrykt i mg/L eller PPM N.
Den kemiske ligning, der driver forholdet mellem ammoniak og ammonium, er:
NH 3 + H 2O <-> NH 4 + + OH -
Når pH-værdien er lav, trækkes ligevægten til højre, og når pH-værdien er høj, trækkes ligevægten til venstre. Generelt, og ved en stuetemperatur med en pH mindre end 6, er andelen af ammoniak-N som NH 3 er meget lav, og næsten alt ammoniaknitrogen er til stede som NH 4 +. Ved en pH på ca. 8 er andelen af NH 3 10 procent eller mindre, og ved en pH på lidt over 9 er den ca. 50 procent. Når pH er > 11, vil alle ammoniumioner i en opløsning blive konverteret til den molekylære form af ammoniak. Aktiviteten af vandholdig ammoniak er meget lavere ved lave temperaturer.
Hvorfor overvåge ammoniak?
Ammoniak bruges både som reagens og som måleparameter inden for flere områder af vand- og spildevandsbehandling.
- Naturligt forekommende ammoniak overvåges i kildevand.
- Nogle gange anvendes ammoniak til pH-kontrol, f.eks. i lægemiddelindustrien.
- Ammoniak overvåges bredt i spildevandsnitrificerings- og denitrificeringsprocesser.
Selv om de generelt er uskadelige ved lave koncentrationer, kan høje koncentrationer af ammoniak forårsage skader og udgøre en sundhedsrisiko. Derfor skal ammoniakniveauerne overvåges og vedligeholdes korrekt.
Hos Hach® kan du finde det testudstyr, ressourcer, træning og software du skal bruge for at kunne overvåge og regulere ammoniak-niveauer i din vandbehandling.
Udvalgte produkter til overvågning af ammoniak
Hach tilbyder mange af de førende spektrofotometre på markedet for vandanalyse.
Mere informationHachs brugervenlige, robuste, transportable instrumenter er bygget til at håndtere de unikke belastninger, der findes i felten.
Mere informationHQ440D Laboratorie multimeter - Ammoniak (NH₃) pakke med ISENH3181 ion selektiv elektrode
Hach HQ440D multimeteret leverer pålidelige målinger, og er både fleksibelt og brugervenligt.
Mere informationISENH4181 Ion Selektive Elektroder
HQD®-målere forbindes med intelligente IntelliCAL®-elektroder, der automatisk genkender testparameteren.
Mere informationHQ-serien er beregnet til fagfolk inden for vandkvalitetsanalyse, som ønsker at udføre elektrokemisk analyse i felt- og laboratoriemiljøer.
Mere informationHachs Amtax sc online-analysator med gasfølsom elektrode er designet til meget præcis bestemmelse af ammoniumkoncentration direkte i processen (udendørs installationer).
Mere informationEZ-seriens ammoniumanalysatorer
EZ-seriens online-analysatorer tilbyder flere muligheder for overvågning af ammonium i vand.
Mere informationHachs digitale, ionselektive A-ISE sc-sonde er designet til bestemmelse af ammoniumkoncentration direkte i mediet.
Mere informationHachs digitale AN-ISE sc-kombinationssensor til ammonium og nitrat udfører kontinuerlige, direkte målinger med en ionselektiv elektrode.
Mere informationSL1000 - PPA Portable Parallel Analyser - Bærbart kolorimeter med USB
Hachs transportable SL1000 analysator (PPA) udfører de samme tests på under det halve antal manuelle arbejdstrin.
Mere informationHach er dedikeret til at levere reagenser af høj kvalitet til både rutinemæssige og krævende vandanalyser.
Mere information
Hvilke processer kræver ammoniakovervågning?
Behandling af overfladevand/grundvand/drikkevand
Ammoniak dannes som biprodukt, når bakterier nedbryder naturlige materialer i jorden. Høje ammoniakkoncentrationer kan forårsages af jernholdig jord, tætliggende skov eller gødning og fækal forurening. Forhøjet indhold af stoffet kan derfor være tegn på forurening. Råvandets indhold af ammonium kan fjernes ved iltning på vandværket, hvorved det omsættes til nitrit og nitrat. iltningen bør tilendebringes da den ellers vil forløbe under ukontrollerede forhold i ledningsnettet med risiko for forøget indhold af nitrit i drikkevandet ved forbrugerne.

Spildevandsbehandling
Under spildevandsbehandling kan ammoniakniveauerne nå ekstremt høje koncentrationer som følge af bakteriel aktivitet. Ammoniak omdannes først til nitrat gennem nitrificeringsprocessen, så det kan reduceres til frit kvælstof (N 2) ved denitrifikation. Lær mere om kommunal spildevandsrensning. Ved høje koncentrationer og pH kan ammoniak være giftig for mikrober, der nedbryder slam. For at undgå skader på vandmiljøet er det desuden afgørende at overvåge og fjerne ammoniak fra spildevandet, før det udledes i naturlige vandområder.

Akvakultur
Som affaldsprodukt fra vandlevende organismer kan ammoniak være giftig for fisk og vandplanter på et niveau helt ned til 0,5 mg/l. I etablerede akvarier kan ammoniak hurtigt omdannes til nitrit og til sidst nitrat. De fleste akvarier sigter mod at have nul ammoniak til stede.
I naturlige vandmiljøer kan høje ammoniakniveauer resultere i overdreven algevækst, der blokerer for sollys og skader lysoptagelse og fotosyntese.

Landbrug
Da planter ikke kan fiksere kvælstof direkte fra atmosfæren, er de afhængige af kvælstoffikseringsbakterier for at omdanne kvælstof til ammoniak. Kvælstof i form af ammoniak kan derefter anvendes af planter til at danne andre væsentlige organiske molekyler, som komplekse organismer har brug for. For at fremme denne naturlige proces (som er en del af kvælstofkredsløbet) tilsættes der ofte ammoniak til gødningen. For eksempel introducerer hydroponiske næringsopløsninger kvælstof som et ammoniaksalt. Ammoniak kan også være til stede i jorden på grund af urin fra dyr og dens sekventielle nedbrydning.

Lægemiddelproduktion
I lægemiddelindustrien anvendes ammoniak til pH-kontrol, og dens opløsning anvendes til at regenerere svage anionbytteresiner og til pH-justering.
Hvordan overvåges ammoniak?
Salicylatmetode
Salicylatmetoden er en variation af fenatmetoden, men den har en fordel, at den er fri for kviksølvsalte og fenol. Denne metode er mest anvendelig ved bestemmelse af ammoniak ved lavt område. Selv om proceduren omfatter flere trin, inden der udvikles en endelig grøn farve, er alle reagenser indeholdt i praktiske pulverpuder (salicylatreagenspulverpuder og alkaliske cyanatpulverpuder) eller en kombination af pulverpuder og LCK kyvettetest.
- Ammoniakforbindelser reagerer med hypoklorit og danner monobloramin.
- Monokloramin reagerer derefter med salicylat og danner 5-aminosalicylat.
- Oxidation af 5-aminosalicylat foretages i nærværelse af en katalysator, nitroprussid (også kaldet nitroferricyanid), hvilket resulterer i dannelsen af indosalicylat, som er en blåfarvet forbindelse. Den blå farve maskeres af den gule farve (fra overskydende nitrofrussid), hvilket giver en grøn opløsning. Intensiteten af den resulterende grønne farve er direkte proportional med ammoniakkoncentrationen i prøven.

Gasdetektionssonde
Ammoniakelektroden måler ammoniakgas i vandige opløsninger eller ammoniumioner, der er blevet konverteret til gas ved tilføjelse af en stærk base. Elektroden er en komplet elektrokemisk celle, der består af en glas-pH-elektrode og en referenceelektrode. Den gaspermeable membran adskiller prøven fra et tyndt lag elektrolyt, der presses mellem pH-pæren og membranen. Ammoniumion omdannes til ammoniakgas ved høj pH. Gassen spredes gennem membranen og forårsager en pH-ændring i det tynde elektrolytlag. Potentialet på tværs af pH-glasset ændres som følge af pH-ændringen, og elektroden måler ændringen i potentialet. Den målte pH-ændring er proportional med ammoniakkoncentrationen i opløsningen.
Stationær/transportabel:
IntelliCAL ®ISENH3181 Ammoniak (NH3) ionselektiv elektrode (ISE)
Online:
Nessler-metode
I ammoniaktesten reagerer Nessler-reagens (K 2HgI 4) med den ammoniak, der er til stede i prøven (under stærkt basiske forhold) for at frembringe en gul art. Farveintensiteten står i direkte forhold til ammoniakkoncentrationen.
2K 2HgI 4 + NH 3 + 3KOH → Hg 2OINH 2 + 7KI + 2H 2O
Stationær model:
Ammoniak reagenssæt, Nessler, 0,02 - 2,50 mg/L NH₃-N
Transportabel:
Test kit, nitrogen , model NI-8
Online:
Ofte stillede spørgsmål
Kan Nessler- og salicylatmetoderne registrere ammoniak eller ammonium?
Både Nessler- og salicylatmetoderne er baseret på en reaktion med molekylær ammoniak i en grundopløsning. Hvis den oprindelige prøve indeholdt ammoniumioner, ville basisreagenserne konvertere den til molekylær ammoniak og derefter reagere og bidrage til det endelige testresultat. Disse enkle ammoniaktest omfatter dog ikke ammoniak, der findes i organisk bundne aminogrupper. En sand total ammoniaktest ville omfatte kloraminer og kræve opvarmning af prøven i en sur opløsning for at fordøje den organiske ammoniak.
Da testresultatet er en sum af både molekylær ammoniak (NH 3) og ammonium ionen (NH 4 +), er kvælstof/nitrogen (-N) den foretrukne enhed til rapportering. De fleste Hach-kolorimetre og -spektrofotometre har mulighed for at konvertere testresultaterne mellem kvælstof (N), ammoniak og ammonium. Dette ændrer ikke testens kemi. Det ændrer kun enhederne. Det skal bemærkes, at selv om der er den samme mængde kvælstof i ammoniak og ammonium, er det støkiometriske forhold mellem N og NH 3 og NH 4 + ikke helt ens på grund af forskellige antal hydrogenatomer.
- For at konvertere fra mg/L NH 3 -N til mg/l NH 3 ganges med 1,216.
- Beregnet ud fra massen af NH 3 divideret med massen af N (17,034 ÷ 14,01 = 1,216).
- For at konvertere fra mg/L NH 3 -N til mg/l NH 4 ganges med 1,288.
- Beregnet ud fra massen af NH 4 + divideret med massen af N (18,042 ÷ 14,01 = 1,288).
Hvad måler Amtax sc-analysatoren?
Når målingen vises på Amtax sc, er enhederne "NH 4 -N" eller "NH 4", hvilket betyder, at instrumentets måling udtrykkes som ammonium og rapporterer værdierne som kvælstof/nitrogen (ammonium N) eller som ammonium. Der er ingen forskel på måden at udtrykke ammoniakkoncentration (som "NH 4 -N" eller "NH 3 -N"), fordi den i begge tilfælde beregnes som kvælstof/nitrogen, og mængden er den samme i begge former.
Amtax sc-analysatoren tilføjer natriumhydroxid (NaOH) til justering af pH og konvertering af ammoniumioner (NH 4 +) til gasformig ammoniak (NH 3), som passerer gennem en ammoniakgasselektiv membran og forårsager et pH-skift af en elektrolytopløsning. Dette pH-skift i elektrolytten måles som et mV-signal, der er proportionalt med koncentrationen af ammoniak (NH 3) i prøven.
Hvilken koncentration af ammoniak er giftig for fisk?
Ammoniak findes i vand enten som ammoniumion (NH 4 +) eller ikke-ioniseret ammoniak (NH 3). Ikke-ioniseret ammoniak er giftig for fisk, mens ammoniumion ikke er giftig, undtagen ved ekstremt høje koncentrationer. Ved neutral pH 7 og omgivelsestemperatur findes næsten al ammoniak som NH 4 +. Efterhånden som pH og temperaturen stiger, stiger mængden af NH 3, og mængden af NH 4 + falder.
For at måle koncentrationen af ikke-ioniseret ammoniak i en prøve skal du følge nedenstående trin:
- Mål koncentrationen af ammoniak ved hjælp af en ammoniakmetode, undtagen metoden til fri ammoniak.
- Mål pH og prøvetemperatur. Se tabellen med titlen "Percentage Un-ionized Ammonia in Aqueous Solution by pH Value and Temperature Calculated from data in Emerson, et. al *" på side 11 i FF2 Freshwater Aquaculture Test Kit Manual.
- Procentdelen af NH 3 bestemmes ved hjælp af tabellen, prøvens pH-værdi og prøvetemperaturen.
- Multiplicer ammoniakkoncentrationen med procenttallet fra tabellen og divider derefter med 100.